在癌細胞的生存競賽中,有一種特殊的“作弊器”——染色體外DNA(ecDNA)。它像是一個游離在細胞內的“外掛程序”,以環狀小圈的形式攜帶關鍵致癌基因,幫助癌細胞“開掛升級”。臨床數據顯示,ecDNA存在于30%至50%的惡性腫瘤中,它的存在顯著加劇了腫瘤侵襲性、治療耐藥性和患者死亡率。
早在1965年,研究人員就在神經母細胞瘤中觀察到當時還被稱為“雙微體”的ecDNA的存在,但受限于技術手段,這個與癌細胞密切相關的潛在靶點的生物學意義長期未被闡明。
4月28日,中國科學院深圳先進技術研究院定量合成生物學全國重點實驗室甘海云團隊在國際學術期刊《細胞》上發表最新研究成果,團隊首次揭示了ecDNA在腫瘤細胞中維持生存的關鍵機制,為理解ecDNA對腫瘤發生發展的作用機制提供了新視角,也為開發靶向ecDNA的抗腫瘤治療策略提供了重要理論依據。深圳先進院為該研究第一單位。
鎖定腫瘤細胞“作弊器”復制漏洞
目前,針對ecDNA的復制機制、表觀遺傳重塑規律及其促癌機制的研究,已成為開發新型抗癌療法的關鍵突破口。清除或干預ecDNA的功能,可能為改善惡性腫瘤治療提供重要策略。
現有的研究表明,ecDNA能在腫瘤細胞分裂演化的過程中持續存在,這就表明其一定能像染色體DNA一樣進行了復制和分配,那么,ecDNA的復制和維持過程是否有其特殊之處呢?
為了破解ecDNA這個癌細胞“作弊器”的謎題,科學家們像偵探破案一樣,精心設計了一套研究方案,采用高科技手段在實驗室里"復刻"了ecDNA:首先用CRISPR基因編輯技術,精準剪下染色體上的特定DNA片段,讓細胞自身以“一條直線首尾粘成圓圈”的形式將其修復成環狀;其次在試管內合成大小接近天然ecDNA的DNA環,再用特殊方法把它送進細胞內,相當于給細胞安裝了一個“外掛程序”。
在構建好合適的細胞系后,研究人員建立了三個對照組,分別為:正常細胞與攜帶ecDNA的細胞、正常染色體DNA與被剪切成ecDNA的同款DNA、腫瘤細胞與攜帶ecDNA的腫瘤細胞。
研究人員通過對ecDNA這個“作弊器”進行“犯罪現場調查”,使用兩種實驗方法觀察并鎖定ecDNA復制的相關蛋白質,從中發現攜帶ecDNA的細胞對DNA損傷應答關鍵因子的抑制劑更加敏感,這些抑制劑能夠顯著降低細胞內ecDNA的含量,有效殺傷攜帶ecDNA的細胞。
揭示關鍵機制,提供腫瘤治療新靶點
DNA損傷應答是細胞為應對DNA損傷啟動的一套“緊急維修系統”。當DNA因輻射、化學毒素及復制錯誤等內源性或外源性的刺激出現損傷時(比如雙鏈斷裂或堿基錯配),細胞會通過損傷應答通路保護基因組穩定。
研究團隊鑒定出的蛋白質中,發現有很多DNA損傷應答相關的因子,這是否意味著ecDNA更容易出現DNA損傷呢?ecDNA又是通過哪種途徑去修復這些損傷呢?
帶著這些疑問,研究人員揭示了ecDNA在癌細胞中持續存在的關鍵機制。他們發現,ecDNA高復制和高轉錄水平會導致DNA結構異常,使得ecDNA比染色體DNA更易發生斷裂。神奇的是,ecDNA利用了細胞里一個平時很少使用的“應急修復工具箱”來維持自己的生存,這是一種快速但易出錯的“自我修復”方式,在正常細胞中只是作為備用方案存在。正是這種“將錯就錯”的修復方式,讓ecDNA既能保持環狀結構繼續“作惡”,又會在修復過程中不斷積累新的突變,使腫瘤變得越來越惡性。這就像給癌細胞裝了一個“變異加速器”,讓它們能更快地進化出耐藥性等危險特性。這項發現解釋了為什么ecDNA陽性的腫瘤往往更具侵襲性,也為開發針對ecDNA修復機制的新型抗癌藥物提供了重要線索。未來或許可以通過阻斷這個“應急修復通道”,讓ecDNA無法自我修復而走向滅亡。
基于此特性,研究人員探討了治療ecDNA陽性腫瘤的可行性方法。通過使用不同靶標蛋白的抑制劑進行處理,證實此類干預策略能顯著降低ecDNA陽性腫瘤細胞內的ecDNA水平,因而這些蛋白有望作為ecDNA治療的通用靶標,為開發廣譜靶向ecDNA的療法提供了新方向。
“我們花費近五年的時間去構建ecDNA細胞系,確定其在腫瘤中的維持機制,以及篩選ecDNA維持的相關蛋白,驚喜地發現了這種ecDNA與DNA修復之間的微妙關系,進一步加深了我們對ecDNA的認知,也填補了目前針對ecDNA作為臨床藥物的理論空白”,文章唯一通訊作者甘海云說道。
該研究系統闡明了腫瘤細胞中ecDNA的獨特生物學特性,這一突破性發現揭示了ecDNA通過平衡態調控參與腫瘤發生發展的分子機制,為臨床轉化提供了新靶點。未來,基于ecDNA分子特征開發的靶向藥物有望成為30至50% ecDNA陽性腫瘤患者的精準治療選擇。

文章上線截圖
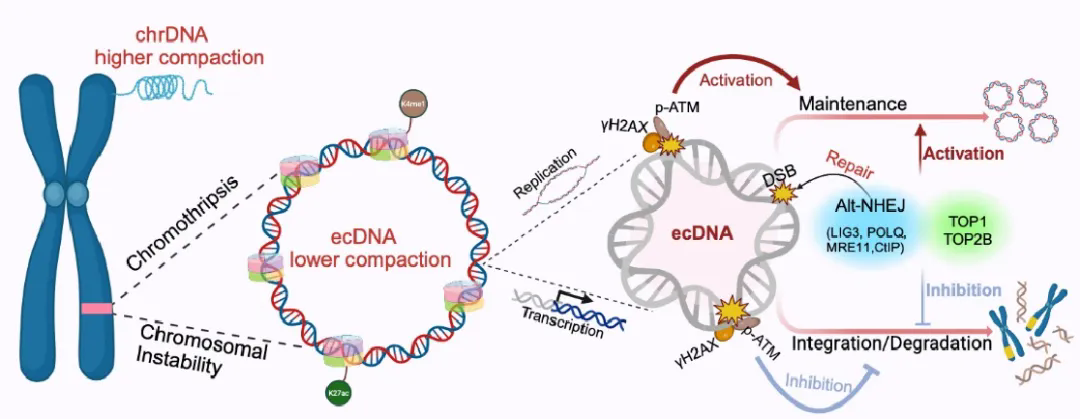
ecDNA維持的分子機制示意圖
附件下載:


